在一項前沿研究中�,來自俄勒岡健康與科學(xué)大學(xué)和加州大學(xué)舊金山分校的科學(xué)家們?nèi)〉昧送黄菩猿晒?����,他們發(fā)現(xiàn)一種實驗性的單一注射能夠在長達30周的時間內(nèi)顯著抑制非人靈長類動物體內(nèi)的猿猴/人類免疫缺陷病毒(SHIV)水平。
SHIV是一種混合了猿猴免疫缺陷病毒(SIV)與人類免疫缺陷病毒(HIV-1)基因片段的病毒��,常用于研究HIV的不同基因功能以及病毒與宿主的互動����。本研究的發(fā)現(xiàn)意味著實驗室合成的注射劑或能成為一種更簡便����、持久的替代方案(當(dāng)前HIV感染者的標準治療需要嚴格的用藥依從性)。
相關(guān)研究結(jié)果發(fā)表在2024年8月9日的Science期刊上�����,論文標題為“Engineered deletions of HIV replicate conditionally to reduce disease in nonhuman primates”����。

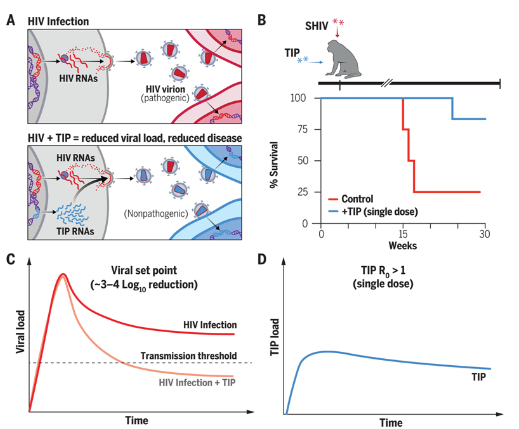
研究人員發(fā)現(xiàn)�,治療性干擾顆粒(TIPs)能夠?qū)⒎侨遂`長類動物體內(nèi)的SHIV水平降低至少1000倍,在六只接受治療的動物中���,有五只的病毒水平顯著下降���。在一只接受治療的動物中�����,SHIV含量降低至檢測不到的水平�。TIPs是由實驗室設(shè)計的非致病性HIV病毒片段����,其快速繁殖,與HIV競爭資源����,旨在抑制感染者體內(nèi)的病毒活性。
論文的共同通訊作者����、加州大學(xué)舊金山分校的病毒學(xué)家Leor Weinberger博士在2000年代初期首次通過計算模型提出了TIP的概念,并在后續(xù)的實驗室研究和小鼠實驗中驗證了這一理論��。共同作者��、俄勒岡健康與科學(xué)大學(xué)的Nancy Haigwood博士表示:“我們看到的疾病進程改變是前所未有的����。如果TIP能在人類HIV感染中產(chǎn)生與我們在非人靈長類動物研究中觀察到的相同效果,那么這將開啟一條新的治療途徑���,可能使人們無需終身服藥�。這是令人振奮的?�!?/p>
四年前���,Weinberger提議與Haigwood合作��,后者在四十年的職業(yè)生涯中一直致力于在非人靈長類動物模型中測試HIV/AIDS疫苗和治療方法���。本次研究首次在非人靈長類動物中評估了TIPs�����,其結(jié)果將為即將進行的人體臨床試驗奠定基礎(chǔ)�。Weinberger評論道:“經(jīng)過20年的研究�����,我們看到了未來HIV感染者不再依賴持續(xù)藥物治療的可能性�����。這些靈長類動物研究預(yù)示著單劑量TIP干預(yù)的潛力,是人體試驗成功的重要信號���?���!?/p>
然而����,真正的考驗將是即將到來的人體臨床試驗���。若TIPs證明有效�,這可能標志著HIV治療新時代的開端�����,為數(shù)百萬人帶來希望����,尤其是在抗病毒藥物獲取困難的地區(qū)。
有希望的治療和預(yù)防
當(dāng)前標準的HIV治療包括每日服用定制的抗逆轉(zhuǎn)錄病毒(ART)藥物組合����,雖然這些藥物能讓人們擁有高質(zhì)量的生活并使大多數(shù)人的HIV水平不可檢測�����,但它們有強烈的副作用����,并可能導(dǎo)致病毒耐藥性����。實驗室制造的抗體也是一種治療手段��,但需終生定期給予���。單次注射且長效的治療方案將極大減輕HIV治療的負擔(dān)和成本。
在本研究中���,六只非人靈長類動物接受了TIP注射����,24小時后暴露于SHIV�。另有四只未接受TIP治療的動物作為對照組。研究團隊對所有十只動物進行了為期30周的監(jiān)測���,定期檢查血液和淋巴結(jié)組織樣本(淋巴結(jié)是HIV感染者的病毒儲存庫)����。
單劑量HIV治療:TIP通過有條件復(fù)制減少非人類靈長類動物的疾病
圖片來自Science, 2024, doi:10.1126/science.adn5866
反復(fù)進行的定量分析顯示�,除了一個例外,所有接受TIP治療的動物體內(nèi)的SHIV DNA和RNA水平遠低于對照組��,SHIV水平降低了1000倍�,比延遲HIV感染者發(fā)展成艾滋病的能力強三倍。
基于這些數(shù)據(jù)�,研究人員通過數(shù)學(xué)模型預(yù)測,單次TIP注射可能將病毒水平永久降至世界衛(wèi)生組織規(guī)定的HIV傳播閾值以下���,意味著單次TIP注射可能阻止HIV感染者向他人傳播病毒�。
研究中未觀察到重組現(xiàn)象�,即不同SHIV毒株感染同一細胞后交換遺傳物質(zhì)形成雜交毒株的過程�����,這是HIV變異和治療難度增加的主要原因之一���。TIPs的這一特性表明它們不會增加HIV治療的復(fù)雜性�。Weinberger、Haigwood及其團隊正在進一步研究TIPs在ART藥物控制下的感染后階段的作用���,以評估在停止ART治療時控制HIV感染的能力�����。
美鳳力借多年的大動物經(jīng)驗,堅持以“務(wù)實求真”為宗旨��,累計為4000多家客戶提供品質(zhì)大動物臨床前服務(wù),得到了客戶的一致好評�。如果您有動物試驗、臨床培訓(xùn)����、組織病理、大動物試驗�、臨床試驗、產(chǎn)品注冊科研課題等...
請立即點擊咨詢我們或撥打咨詢熱線: 17312606166 �����,我們會詳細為你一一解答你心中的疑難。 添加好友




 17312606166
17312606166